Grey Leaf Spot – Biologie des Erregers
Neue Schaderreger erfordern neue Konzepte
(Anm. d. Red.: Bereits in der letzten Ausgabe des Greenkeepers Journal hatten wir einen Beitrag unseres Autors Dr. Gerhard Lung zum Schaderreger Grey Leaf Spot eingebunden. Da das Thema derzeit für viel Furore auf Golfanlagen sorgt, hat sich die Fachredaktion dazu entschlossen, einen weiteren hierzu eingereichten Beitrag zu veröffentlichen.)
Zusammenfassung
Mit Grey Leaf Spot hatten wir es im Sommer 2018 in Deutschland mit einem seltenen Krankheitserreger zu tun. Das Vorkommen des Erregers resultierte aus einer Kombination verschiedener Faktoren, die mit den überdurchschnittlich hohen Temperaturen und der lang anhaltenden Trockenheit zusammenhingen. Der Schadpilz selbst ist ein „Komplex“, da es sich nicht nur um zwei verschiedene Pyricularia-Arten handelt, sondern auch, weil es von beiden Spezies zusätzlich noch Pathotypen gibt, die das Wirtspflanzenspektrum bestimmen. Für das Rasenmanagement gibt es einige Punkte, die, wenn diese beachtet werden, zumindest die Stärke eines Befalls minimieren könnten.
Die Situation
Der Sommer 2018 war sowohl lang, als auch warm, überdurchschnittlich warm. Wahrscheinlich durch die lange, warme Witterung ist die in Deutschland eher selten auftretende Krankheit „Grey Leaf Spot“ (Brit.: Grey Leaf Spot, Amerik.: Gray Leaf Spot) vermehrt in Fußballarenen sowie auf benachbarten Trainingsplätzen beobachtet worden. Die Blätter der Gräser wurden in wenigen Tagen massiv von grauen Blattnekrosen befallen und somit zumindest lokal zerstört. Photosynthese und Stofftransport im Gewebe waren nicht mehr möglich (Abbildung 1). Die Konsequenzen eines Befalls waren teilweise drastisch und führten häufig zu einem großflächigen Ausfall der Grasnarbe. Oft war eine komplette Erneuerung der Grasfläche erforderlich.
Die Biologie des Erregers
Die Krankheit wird durch den Schadpilz Pyricularia spp. verursacht. In der Fachliteratur gibt es zwei Spezies von Pyricularia, die mit Grey Leaf Spot (GLS) in Verbindung gebracht werden: P. grisea und P. oryzae. Diese Arten lassen sich morphologisch nicht unterscheiden, eindeutig ist jedoch eine DNA-Sequenz-Analyse. Pyricularia ist die Anamorphe (Nebenfruchtform, asexuelle Morphe) von der Teleomorphe (Hauptfruchtform oder sexuelle Morphe) Magnaporthe, mit den beiden Arten M. grisea bzw. M. oryzae. Bei den „Cool-Season-Rasengräsern“ werden vor allem die beiden Lolium-Arten – L. multiflorum und L. perenne – sowie Festuca arundinacea (Rohrschwingel) durch GLS befallen. Der Pilz überlebt ungünstige Perioden als Myzel in abgestorbenem Pflanzenmaterial der Wirtspflanzen. Wenn die Bedingungen für die Entwicklung des Pathogens günstig werden, bilden sich Konidienträger mit zahlreichen Konidien am nekrotischen Pflanzengewebe. Diese Konidien werden mit dem Wind, dem Wasser sowie mit Arbeitsgeräten, die zur Rasenpflege eingesetzt werden, und durch Schuhsohlen verbreitet. Konidien werden besonders zahlreich bei warmer/feuchter Witterung gebildet. Für eine erfolgreiche Konidienkeimung sowie eine Blattinfektion sind eine hohe relative Luftfeuchtigkeit sowie eine anhaltende Blattnässe maßgebend.
Optimale Befallsbedingungen
Beste Bedingung für das Auftreten von GLS bietet eine warme und feuchte Witterung. Die optimale Temperatur für die Krankheitsentwicklung liegt zwischen 28 und 32 °C. Die Lufttemperatur allein ist für eine Blattinfektion jedoch nicht entscheidend, sondern die Kombination mit der Blattnässedauer: Bei suboptimalen Temperaturen (20-23 °C) wird eine Blattnässedauer von 21 bis zu 36 Stunden für eine Infektion gebraucht; bei optimalen Temperaturen (28-32 °C) erfolgt eine Infektion bereits innerhalb von neun Stunden – vorausgesetzt, dass die Blattnässe über diese Zeit erhalten bleibt.
Neben der Überdauerung des Schadpilzes als Myzel in befallenem Pflanzengewebe, kann er auch mit dem Saatgut übertragen werden. Das ganze Krankheitsbild wird noch zusätzlich dadurch verkompliziert, indem es sogenannte „Pathotypen“ des Erregers gibt. Ein Pathotyp eines Krankheitserregers wird wie folgt definiert: Ein Pathotyp ist eine Unterteilung einer Spezies, die durch ihre Pathogenität gegenüber verschiedenen Wirtspflanzen charakterisiert wird. D.h., ein Isolat von z.B. Pyricularia grisea ist auf einer L. perenne-Sorte pathogen (= verursacht Schäden), diese Pathogenität ist jedoch bei anderen L. perenne-Sorten nicht gegeben.
Nachweis des Erregers
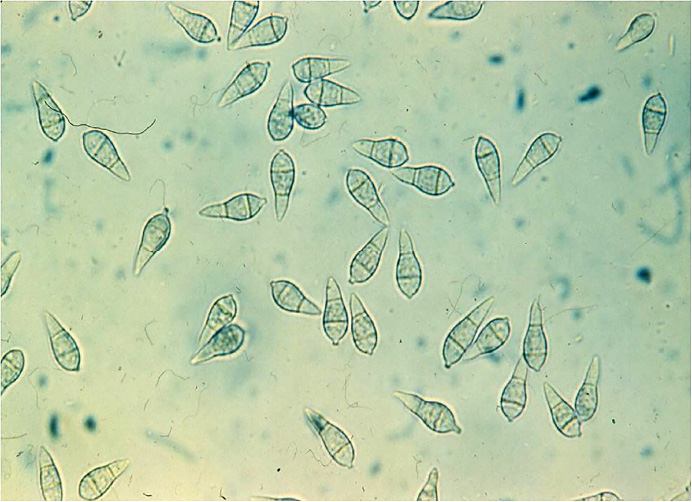
Der Erreger lässt sich ganz einfach nachweisen: Mit der herkömmlichen mykologischen Methode können die charakteristischen birnenförmigen, meist dreizelligen Konidien einfach erkannt werden (Abbildung 2). Alternativ wird eine genetische Bestimmung, die DNA-Analyse, angewandt. Der Vorteil einer klassischen (= mykologischen) Bestimmung ist, dass sie im Prinzip von jedem Greenkeeper durchgeführt werden kann. Der Nachteil dieser Art der Bestimmung ist die benötigte Zeit, bis das Ergebnis vorliegt: circa 3-4 Tage. Bei der genetischen Analyse liegt zwar das Ergebnis generell viel schneller vor, eine Probe muss jedoch entweder zu einem entsprechend ausgestatteten Labor weggeschickt werden oder die dafür notwendigen Nachweismöglichkeiten liegen vor Ort vor.
In eigenen Untersuchungen von Rasenproben im Sommer 2018 konnte Grey Leaf Spot in Stadien und auf Trainingsplätzen an fünf Standorten in Deutschland nachgewiesen werden. Proben aus Frankreich, der Schweiz und Österreich zeigten ebenfalls einen Befall mit GLS. Für eine erfolgreiche Infektion wird neben höheren Temperaturen auch eine lang anhaltende Blattnässe benötigt. In 2018 hat die Witterung die hohen Temperaturen geliefert, die lang anhaltende Blattnässe hat der Mensch selbst geschaffen. Häufige Rasenbewässerung zur Sicherstellung der Wasserversorgung und auch für eine Abkühlung der Rasengräser führt zu einer langen Nässe auf den Blättern. Ideale Bedingungen für den Befall mit GLS. Dazu kommt die hohe Stickstoffversorgung auf Sportrasenflächen. Es ist in der Fachliteratur dokumentiert, dass Pflanzen, die hoch mit Stickstoff versorgt werden, auch besonders anfällig für einen GLS-Befall sind. Da der Befall teilweise auch auf den Trainingsplätzen nachzuweisen war, wurde die Situation noch verschlimmert. Konidien oder Myzelreste des Pilzes könnten an den Sohlen der Spielerschuhen anhaften und so verbreitet werden – eine „ständige“ Neuinfektion des Stadionrasens wurde dadurch garantiert.
Kontrollmöglichkeiten
Wie sind die Aussichten für die Saison 2019? Es hängt absolut alles mit dem Wetter zusammen. Sollten wieder hohe Temperaturen in den Sommermonaten herrschen, werden die Bedingungen für einen GLS-Befall wieder gegeben sein. Es sei denn, dass das Grasflächenmanagement andere Wege geht:
- Optimale Stickstoffversorgung statt Stickstoff im Überfluss – auch die Stickstoffform ist wichtig, schnell verfügbarer Stickstoff sollte vermieden werden.
- Bei vorhandenem Befall keine Nachsaaten von Juni/Juli bis Ende September.
- Da es tolerante Sorten von L. perenne gibt, könnte ihre Verwendung den Befall reduzieren – dies hängt jedoch davon ab, welcher Pathotyp des Krankheitserregers vorhanden ist.
- Der Einsatz von Fungiziden wäre auch eine Möglichkeit. Die in Deutschland für eine Anwendung im öffentlichen Grün zugelassenen Fungizide sind auf nur sehr wenige Wirkstoffe und Wirkstoffgruppen beschränkt. Eine Wirkung gegen Pyricularia spp. wird der Wirkstoffgruppe „Strobilurine“ zugeschrieben (wie z.B. Azoxystrobin im Produkt „Amistar“ oder Pyraclostrobin im Produkt „Signum“ und Trifloxystrobin im Produkt „Exteris Stressgard“).
Eine Zulassung für eine Bekämpfung von GLS ist in Deutschland jedoch bei keinem dieser Produkte vorhanden. Zudem ist eine Fungizid-Resistenzbildung gegenüber Strobilurin-haltigen Produkten bei Pyricularia spp. weit verbreitet.
Weiterführende Literatur
BALLINI, E., T.T.T. NGUYEN and J.-B. MOREL, 2013: Diversity and genetics of nitrogen-induced susceptibility to the blast fungus in rice and wheat. Rice (NY) 6: 32.
KLAUBAUF, S., D. THARREAU, E. FOURNIER, J.Z. GROENEWALD, P. CROUS, R.P. DE VRINS and M.-H. LEBRUN, 2014: Resolving the polygenetic nature of Pyricularia (Pyriculariaceae). Studies in Mycology 79: 85-120.
KUMAR, B. and R. YADAV, 2012: Influence of nitrogen fertilizer dose on blast disease of finger millet caused by Pyricularia grisea. Indian Phytopathology 65: 52-55.
KUSABA, M., K. HIRATA, Y. SUMIDA, A. YAMAGASHIRA, H. KONAGAI-URATA and H. YAEGASHI, 2006: Molecule genetic characterization and host specificity of Pyricularia isolates from annual ryegrass in Japan. Plant Pathology Journal 5: 72-79.
SMILEY, R.W., P.H. DERNOEDEN and B.B. CLARKE (eds.), 2005: Compendium of Turfgrass Diseases. APS Press, St. Paul, Minnesota, USA.
YANNI, Y.G. and M.R. SEHLEY, 1991: Rice performance and natural infection with blast (Pyricularia oryzae Cav.) under different algalization techniques and rates of fertilizer nitrogen. World Journal of Microbiology and Biotechnology 7: 43-47.
Autor: Dr. John Speakman | Greenkeepers Journal 01/2019